Jännittävät metallit: Oppilaan osa
Tavoitteet
Työn tavoitteena on oppia sähkö- ja metallien kemiaa sekä tutustua erilaisiin molekyylimalleihin, jotka on toteutettu JMOL -ohjelmistolla. Lisäksi tarkoituksena on saada iloa ja elämyksiä kemian opetuksesta.
Esitutkimuksia metalleista
Esikysymyksiä
Alkajaisiksi muistele, minkä nimisiä metalleja on olemassa.
- Mitä ominaisuuksia metalleilla oikein on?
- Muistatko vielä, mikä aiheuttaa metallien yhteiset ominaisuudet? Huom. voit käyttää avuksesi piirroksia!
- Osaatko selittää miksi metallit ovat hyviä sähkönjohteita, entä helposti muokattavia?
Toteutus:
Tarvitset kuparilevyn ja vasaran
Työohje: Hakkaa levyä vasaralla. Varo, ettet osu peukaloon! Voit myös yrittää taivutella levyä.
Mallinnusharjoitus
- Miltä luulet, että metallin rakenteelle tapahtui atomitasolla?
- Tarkastele alla olevia malleja.
Jos et aivan muistanut kaikkia metallien ominaisuuksia tai sitä, millainen metallisidos itse asiassa on, lue lisätietoa kemiallisesta näkökulmasta.
Lue lisää
Kemiallinen näkökulma
Metallien yhteisiä ominaisuuksia ovat mm. kiiltävyys, kovuus (muutamaa poikkeusta lukuun ottamatta, esim. Na, Hg), muokattavuus, taottavuus, sitkeys, sähkön- sekä lämmönjohtavuus. Lisäksi niiden uloimmalla elektronikuorella on yleensä 1 tai 2 elektronia.
Merkittävin tekijä metallien yhteisille ominaisuuksille on niiden rakenne eli metallisidos. Metallit ovat nimittäin hyviä sähkönjohteita siksi, että niissä on paljon vapaita elektroneja. Sähkö on elektronien liikettä. Metallisidoksessa atomin ulkoelektronit pääsevät helposti irralleen. Tällöin syntyy positiivisten ionien muodostama hila ja sitä ympäröivä elektronimeri. Elektronimeren vapaat elektronit kuljettavat sähköä.
Metallien reaktiivisuus suolahapon kanssa
Toteutus:
Tässä työssä tarvitset erilaisia metalleja, koeputkia sekä koeputkitelineen. Tulitikutkin ovat tarpeellisia. Nyt työturvallisuus on hyvin tärkeätä! Käytä siis hanskoja ja suojalaseja!
Työohje:
- Laita kuhunkin koeputkeen pieni luraus 10 % suolahappoa. Lisää jokaiseen koeputkeen vielä ripaus jotakin metallijauhetta tai pieni pala metallia. Jotta tuloksesi olisivat mahdollisimman tieteellisiä, pyri käyttämään joko metallijauheita tai -paloja. Yritä pitää metallien määrät samoina!
- Tee havaintoja reaktioiden voimakkuuksista.
- Yritä tunnistaa koeputkista kupliva kaasu päättelemällä tai viemällä palava tulitikku varovasti koeputken yläpuolelle.
- Voit kaataa koeputkien sisällöt viemäriin runsaan veden kanssa. Ota liukenemattomat metallit talteen!
Pohdintaa
- Laita metallit järjestykseen sen mukaan, kuinka kiivaasti ne reagoivat suolahapon kanssa.
- Oletkin varmaan kuullut jalometalleista. Miten ne ovat erilaisia kuin muut metallit? Mitkä tutkimuksessa käytetyistä metalleista olivat jalometalleja? Miten ne reagoivat suolahapon kanssa?
- Metallit voidaan luokitella kahteen ryhmään eli jaloihin ja epäjaloihin metalleihin. Jos metallit halutaan laittaa tarkempaan järjestykseen, on avuksi otettava jännitemittari.
Mallinnusharjoitus
- Entä millainen reaktio tapahtui kun metalliatomi reagoi vetykloridin kanssa? Nyt voit tutkia, mitä reaktiossa tapahtuu alla olevien molekyylimallien sekä reaktiota havainnollistavan animaation avulla.
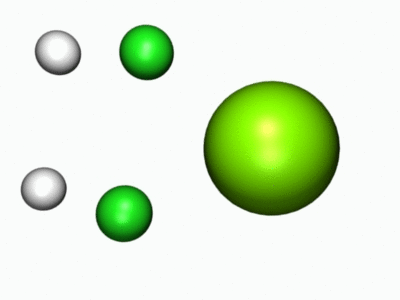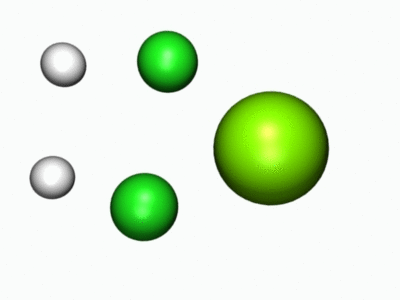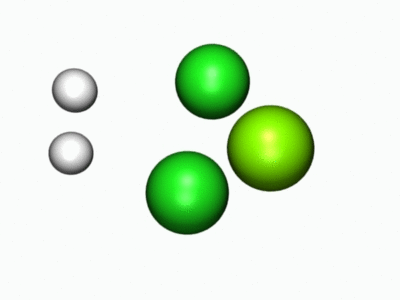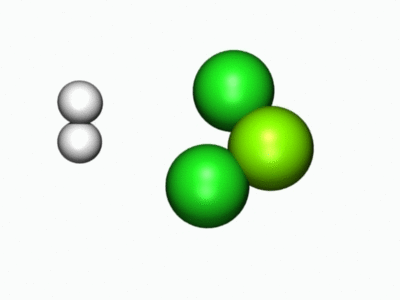
Jos osa kysymyksistä tuntui hankalilta, lue lisätietoa Kemiallisesta näkökulmasta.
Lue lisää
Kemiallinen näkökulma
Metallit liukenevat suolahappoon eri nopeuksilla kuparia, kultaa ja hopeaa lukuun ottamatta. Se mikä metalli liukenee nopeammin kuin toinen riippuu metallien sähkökemiallisesta jännitesarjasta:
Sähkökemiallisesta jännitesarjasta nähdään, että esimerkiksi magnesiumin hapettumiskyky on suurempi kuin esimerkiksi sinkillä. Siis magnesiumin reaktion voisi olettaa olevan kiivaampi.
Hapettuminen ja pelkistyminen tapahtuvat aina yhtä aikaa. Aine hapettuu, kun se luovuttaa elektroneja. Kun aine vastaanottaa elektroneja, sen sanotaan pelkistyvän. Hapettunut metalli on aina ionimuodossa ja pelkistynyt atomimuodossa!
Hapettumisen ja pelkistymisen kannalta magnesiumkloridi on suola, joten siinä magnesium on ionimuodossa. Magnesium hapettuu siis reaktiossa. Toisaalta hapon liuetessa veteen vapautuu vetyioneja H+. Koska vetymolekyylit ovat varauksettomia ja ne sisältävät vetyatomeja, ovat vetyionit pelkistyneet eli ottaneet vastaan elektroneja.
Hapettumis- ja pelkistymisreaktioissa metalliatomien ja -ionien välillä voi liikkua elektroneja. Elektronit siirtyvät aina hapettuvalta metalliatomilta pelkistyvälle metalli-ionille. Jos voisimme ohjata elektronit kulkemaan tiettyä reittiä pitkin, saisimme aikaan sähkövirran.
Sähkökemiallinen pari
Toteutus:
Tarkoituksenasi on koota sähkökemiallinen pari kupari- ja sinkkilevystä. Tarvitset ainakin johtimia, sitruunan ja hauenleukoja.
KOKOA PARI OHEISEN KUVAN MUKAISESTI, ja kun olet tehnyt sen, tee tarvittavia kokeita ja selvitä seuraavat seikat:
- Mikä on metallilevyjen välinen jännite?
- Miten jännite muuttuu, kun vaihdat hauenleukojen paikkaa metallista toiseen?
- Vertaa jännitettä tavallisen pariston jännitteeseen.
- Mitä jännitteelle tapahtuu, kun levyt koskettavat toisiaan? Miksi?
- Yritä saada lamppu syttymään tavallisen pariston avulla. Mitä huomaat? Huolehdi jätteiden asiallisesta loppukäsittelystä!
Sähkökemiallisesta parista voit lukea lisää kemiallisesta näkökulmasta.
Lue lisää
Kemiallinen näkökulma
Kun hapettumis-pelkistymisreaktio tapahtuu siten, että hapettuva ja pelkistyvä aine eivät ole suorassa kosketuksessa, on mahdollista tuottaa sähkövirtaa. Tällainen systeemi on nimeltään galvaaninen kenno eli sähkökemiallinen pari. Kennossa muutetaan siis kemiallista energiaa sähköenergiaksi. Metalleista todellakin saadaan sähköä!
Yksinkertaisin galvaaninen kenno rakentuu kahdesta elektrodista, jotka on molemmat upotettu elektrolyyttiliuoksiin. Elektrodit on lisäksi liitetty toisiinsa sähköjohdoilla ja elektrolyyttiliuosten välillä on suolasilta. Meidän työssämme elektrolyyttiliuoksena toimii sitruuna ja elektrodeina kaksi metallilevyä.
Elektrodit toimivat kennossa reaktiopaikkana. Niiden pinnalla tapahtuvat siis hapettumis- ja pelkistymisreaktiot. Anodi on elektrodi, jolla tapahtuu hapettumisreaktio ja katodi on elektrodi, jolla tapahtuu pelkistymisreaktio. Näitä hapettumis- ja pelkistymisreaktioita voidaan kutsua myös anodi- ja katodireaktioiksi. Kennossa tapahtuva kokonaisreaktio on anodi- ja katodireaktioiden summa. Elektrolyyttiliuoksella tarkoitetaan yleisesti ottaen liuosta, joka johtaa sähköä.
Työssä määritetään galvaanisen kennon lähdejännitettä. Mittaamalla kennojen lähdejännitettä voidaankin itse asiassa määrittää aineiden pyrkimyksiä hapettua ja pelkistyä. Lähdejännite on nyt sitä suurempi, mitä enemmän reagoivien aineiden taipumus sitoa elektroneja eroaa toisistaan. Toisin sanoen metallilevyjen välinen jännite riippuu käytettävistä metalleista. Metallit on järjestetty jännitesarjaksi sen mukaan, kuinka suuri jännite metallien välille saadaan. Sähkökemiallisessa parissa syntyvä jännite on sitä suurempi, mitä kauempana metallit ovat toisistaan jännitesarjassa.
Avaimen kuparointi
Toteutus:
Työssä tarvitaan:
- Keitinlasi (250 ml)
- Kuparisulfaatti-liuos 5 %, CuSO4 (50 ml)
- Puhdistettu kuparilevy
- Virtalähde/Paristo (jännitteen suuruus 2-3 V)
- Puhdistettu avain/naula
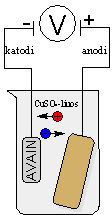
Työn toteutus:
- Valmista 50 ml 5 % CuSO4-liuosta liuottamalla 2,5 g kiinteää kuparisulfaattia 50 ml:aan vettä.
- Laitetaan keitinlasiin 50 ml CuSO4-liuosta
- Laitetaan liuokseen puhdistettu kuparilevy ja kytketään se virtalähteen plusnapaan
- Kytketään miinusnapaan hyvin puhdistettu avain
- Kytketään virtalähteeseen 2-3 V:n jännite
- Seurataan, mitä tapahtuu
- Kun avain on saanut ruskean pinnan, sammutetaan virtalähde, irrotetaan avain ja annetaan sen kuivua
- Hangataan avainta kevyesti kankaalla tai teräsvillalla
Visualisointiharjoitus
Tutki oheisia malleja ja kuvia. Miten kiteisen kuparisulfaatin ja kuparisulfaattiliuoksen koostumukset eroavat atomitasolla? Alimmaisen kuvan kohdalla, osaatko sanoa, miksi vesimolekyylit ovat asennoituneet kupariatomia kohden juuri kuvan osoittamalla tavalla?
HUOM! Tutki täältä veden värähtelyjä. Tämän tarkoitus on havainnollistaa sitä, että molekyylit liikkuvat myös itsensä suhteen koko ajan eri tavoin.
Katselkaa nyt simulaatio elektrolyysistä! Valitse vasemmalle puolelle (anodille) metalliksi kupari ”Copper” ja oikealle puolelle (katodille) metalliksi rauta ”Iron”. Valitse elektrolyyttiliuokseksi Kuparinitraattiliuos Cu(NO3)2. Laita jännite 2 Volttiin ja paina ”ON”. Ensin näit mitä molekyylejä liuoksessa on ja nyt huomaat vielä miten ne liikkuvat liuoksessa. Huomaatko saman päällystymisen simulaatiossa kuin huomasit kokeen aikana?
Elektrolyysistä voit lukea lisää kemiallisesta näkökulmasta.
Lue lisää
Kemiallinen näkökulma
Systeemi, jossa tietyt kemialliset reaktiot saadaan tapahtumaan sähkövirran avulla, on elektrolyysi. Reaktion tapahtumispaikka on elektrolyyttiliuos, jossa liikkuu sähköä kuljettavia ioneja. Samalla tavalla kuin galvaanisessa kennossa, anodilla tapahtuu hapettuminen ja katodilla pelkistyminen. Tässä työssä anodina toimii kuparilevy, jossa siis kupariatomit hapettuvat kupari-ioneiksi, samalla katodilla nämä kupari-ionit pelkistyvät kupariatomeiksi, jolloin naula tai avain pinnoittuu kuparilla. Oheisessa kuvassa näkyy vielä paremmin mitä reaktiossa tapahtuu.
Mysteeri
Toteutus:
Saat eteesi neljä koeputkellista metallisuolojen liuoksia. Tehtävänäsi on selvittää, minkä metallin suolaa missäkin koeputkessa on. Liuoksista yksi on hopeanitraatti, toinen tinakloridi, kolmas sinkkisulfaattia ja neljäs kuparisulfaattia.
Selvitystyössäsi saat käyttää apuna ainoastaan metallien jännitesarjaa sekä rauta- ja kuparipalasia.
Suunnittele tutkimuksesi huolellisesti ja kirjaa havaintosi ylös. Ole huolellinen, ettet mene koeputkissa sekaisin.
Vinkki 1
Mallinnusharjoitus
Tutustu oheiseen mallinnukseen, jossa ovat mysteerin ioniyhdisteet. Yhdistä ne yhdisteiden kemiallisiin kaavoihin. Huom. Mukana on myös yksi hämäysmalli, mikä se on ja mitä molekyyliä se kuvaa?
Vinkki 2
Listaa mitä atomeja ja montako kutakin yhdisteissä on.
Vinkki 3
Mieti sinkkikloridin ja tinakloridin tapauksessa, kumpi ioni (Zn vai Sn) on kooltaan suurempi. Apua voit löytää esimerkiksi sivustolta http://abulafia.mt.ic.ac.uk/shannon/ptable.php.